Программа Составления Химических Уравнений
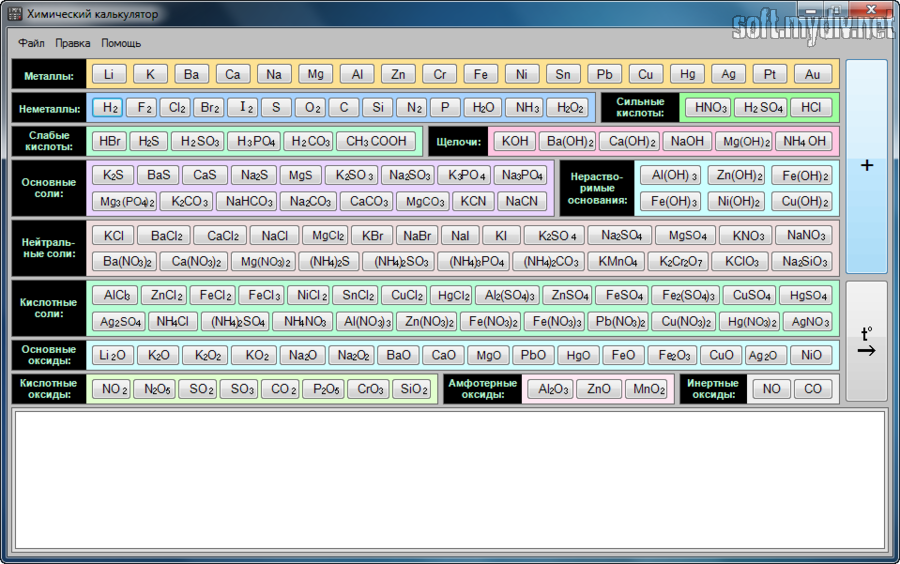
Posted : admin On 20.09.2019Окислительно-восстановительные реакции 300 IП. Упражнения по составлению химических уравнений 302 Ответы 306. Реакции обмена в растворах. Основная информация о программе. Программа Химический калькулятор служит для получения быстрого решения уравнений реакций из неорганической химии. В несколько нажатий вы получите полностью готовое химическое уравнение с расставленными коэффициентами. Работа программы схожа с работой математического калькулятора. То есть вы нашли, нажали и получили. Существенное преимущество программы, которое отличает её от других подобных программ-калькуляторов – библиотека готовых формул веществ, которая сильно экономит ваше время. Но особенность вовсе не мешает привычному решению уравнений. Программы → Android → Хобби. Скачать на Трешбоксе. Android 2.3+ Другие версии. Химия — решение химических уравнений, цепочек, решение уравнений с несколькими неизвестными, отображение формул органической химии. Поиск ионных реакций. Таблица Менделеева и таблица растворимости веществ будут всегда под рукой. Скачать Химия 1.7. Проверен Вирусы не найдены QR Разрешения (3). Скачать Химия 1.06. Проверен Вирусы не найдены QR Разрешения (2). Балансировка химического уравнения - онлайн балансировкa. Введите химические уравнения, чтобы их сбалансировать: Инструкция по балансировке химических уравнений: Введите уравнение химической реакции и нажмите 'Уравнять'. Ответ на этот вопрос появится ниже. Всегда используйте верхний регистр для первого символа в названии химического элемента и нижнем регистре для второго символа.
- Программа Для Составления Химических Уравнений
- Программа Для Составления Химических Реакций Онлайн
- Программа Для Составления Химических Реакций
Алгоритмы составления химических формул и уравнений химических реакций. Валентность Составление формул по валентности Алгоритм решения Пример 1.
Запишите символы элементов (согласно ряду электроотрицательности) Аl О 2. Запишите валентность элементов (по периодической системе) III II Аl О 3. Найдите наименьшее общее кратное (нок) между числовыми значениями валентности 6 III II Аl О НКО =6 4.
Найдите соотношение между атомами элементов (деля НОК на соответствующую валентность). Полученные значения являются индексами 6 III II Аl О 6: 3=2 6: 2= 3 →2:3 5. Запишите формулы веществ Аl 2 О 3 Определение валентности по формуле Алгоритм решения Пример 1. Запишите формулу вещества Р 2 О 5 2.
Обозначьте известную валентность элемента II Р 2 О 5 3. Найдите наименьшее общее кратное (нок) между числовыми значениями валентности 10 II Р 2 О 5 НОК =10 4. Поделите наименьшее общее кратное на количество атомов другого элемента. Полученный ответ и является искомой валентностью 10 V II Р 2 О 5 10: 2=5 5. Сделайте проверку перемножьте валентность на индекс каждой части формулы.
Выбрать другой продукт. Удобный доступ к поддержке. Зарегистрировать продукт. Драйверы и Утилиты. Драйверы и Утилиты BIOS и ПО. Драйверы asus p5k. Поддерживает процессоры LGA775 Intel® Quad-core. Эта материнская плата поддерживает новейшие процессоры Intel® Quad-core LGA775.
Их производные должны быть равны V II Р 2 О 5 10 = 10 Степень окисления 1.Элемент в простом веществе имеет нулевую степень окисления. 2.Все металлы имеют положительную степень окисления. Водород имеет в соединениях степень окисления (+1), исключая гидриды ( соединения водорода с металлами главной подгруппы первой, второй групп, степень окисления -1, например Na +H - ); 5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O +2F - 2 и в перекисях( Н 2О 2 - степень окисления кислорода (-1). 6.Фтор имеет степень окисления (-1) 7. Алгебраическая сумма степеней окисления равна 0 Алгоритм определения степени окисления по формуле Задание. Определите степень окисления в соединении Р 2О 5 1.Запишите формулу заданного вещества Р 2О 5 2. Запишите значение степени окисления элемента, у которого она постоянна Р 2О 5 -2 3.
Найдите общее число степени окисления известного элемента (-2) ∙ 5= - 10 4. Общее число положительной степени окисления численно равно общему числу отрицательной степени окисления Р 2 О 5 -2 +10 -10 5. Найдите величину положительной степени окисления, разделив ее на индекс у этого элемента (+10) ꞉ 2 = +5 6. Поставьте значение степени окисления Р 2 +5 О 5 -2 Определить степени окисления в соединении K 2Cr 2O 7 У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)7=(-14), у калия (+1)2=(+2). Число положительных степеней окисления равно числу отрицательных.
Следовательно (-14)+(+2)=(-12). Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит на один атом приходится (+12):2=(+6), записываем степени окисления над элементами К + 2Cr +6 2O -2 7 Алгоритм составление химических формул по степени окисления 1. Записать химические знаки элементов Аl S 2. Определить степень окисления Аl +3 S -2 3.
Найти наименьшее общее кратное и определить индексы Аl +3 S -2 НОК =6 4.Формула Аl 2 +3 S 3 -2 Алгоритм составления уравнений реакций Последовательность действий Пример 1. В левой части уравнения приведем формулы веществ, вступающих в реакцию (реагентов) Р+ O 2→ 2. В правой части после стрелки пишем формулы веществ, образующихся в результате реакции(продуктов) Р + O 2→Р 2O 5 3 С помощью коэффициентов начинаем уравнивать число тех атомов,которых в реакцию вступает больше (через НОК) нок 10 Р+ 5O 2→2Р 2O 5 4. С помощью коэффициентов уравниваем число других атомов 4Р+ 5O 2→2Р 2O 3 Составление уравнений окислительно-восстановительных реакций В методе электронного баланса сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Алгоритм составления окислительно- восстановительных реакций Последовательность действий Пример Составить схему реакции. CuCl 2 + Al ® AlCl 3 + Cu Определить элементы, атомы которых изменили степень окисления в результате реакции. +2-1 0 +3-1 0 CuCl 2 + Al ® AlC l3 + Cu Найти окислитель и восстановитель.
+2 0 Cu + 2ē = Cu восстановление окислитель 0 +3 Al - 3ē = Al окисление Восстановитель Составить электронные уравнения для процессов окисления и восстановления +2 0 Cu + 2ē = Cu 3 восстановление окислитель 0 +3 Al - 3ē = Al 2 окисление Восстановитель Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, а затем – перед формулами окислителя и восстановителя 3 CuCl 2 + 2Al ® 2AlCl 3 + 3Cu Составление ионных уравнений реакций Последовательность действий Пример 1. Записать молекулярное уравнение реакции, подобрать коэффициенты АlСl 3 + 3КОН→Аl(ОН) 3↓+ 3КСl 2.
С помощью таблицы растворимости определить растворимость каждого вещества АlСl 3 – р; КОН – р; Аl(ОН) 3↓- н; КСl - р 3. Составить полное ионное уравнение реакции, записав электролиты в виде ионов, неэлектролиты – в молекулярном виде Аl 3+ +3Сl - + 3К 3ОН -→Аl(ОН) 3↓+ 3К 3Сl - 4. Составить сокращенное ионное уравнение реакции, сократив одинаковые ионы в левой и правой частях уравнения Аl 3+ +3ОН -→Аl(ОН) 3↓. Алгоритмы составления химических формул и уравнений химических реакций. Валентность Валентность – способность атомов присоединять к себе определенное число других атомов Составление формул по валентности Алгоритм решения Пример 1.
Запишите символы элементов (согласно ряду электроотрицательности) Аl О 2. Запишите валентность элементов (по периодической системе) III II Аl О 3. Найдите наименьшее общее кратное (нко) между числовыми значениями валентности 6 III II Аl О НКО =6 4. Найдите соотношение между атомами элементов (деля НКО на соответствующую валентность). Полученные значения являются индексами 6 III II Аl О 6: 3=2 6: 2= 3 →2:3 5. Запишите формулы веществ Аl 2 О 3 Определение валентности по формуле Алгоритм решения Пример 1.
Запишите формулу вещества Р 2 О 5 2. Обозначьте известную валентность элемента II Р 2 О 5 3. Найдите наименьшее общее кратное (нко) между числовыми значениями валентности 10 II Р 2 О 5 НКО =10 4. Поделите наименьшее общее кратное на количество атомов другого элемента. Полученный ответ и является искомой валентностью 10 V II Р 2 О 5 10: 2=5 5. Сделайте проверку перемножьте валентность на индекс каждой части формулы. Их производные должны быть равны V II Р 2 О 5 10 = 10 Степень окисления 1.Элемент в простом веществе имеет нулевую степень окисления.
2.Все металлы имеют положительную степень окисления. Водород имеет в соединениях степень окисления (+1), исключая гидриды ( соединения водорода с металлами главной подгруппы первой, второй групп, степень окисления -1, например Na +H - ); 5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O +2F - 2 и в перекисях( Н 2О 2 - степень окисления кислорода (-1). 6.Фтор имеет степень окисления (-1) 7. Алгебраическая сумма степеней окисления равна 0 Алгоритм определения степени окисления по формуле Задание. Определите степень окисления в соединении Р 2О 5 1.Запишите формулу заданного вещества Р 2О 5 2. Запишите значение степени окисления элемента, у которого она постоянна Р 2О 5 -2 3.
Найдите общее число степени окисления известного элемента (-2) ∙ 5= - 10 4. Общее число положительной степени окисления численно равно общему числу отрицательной степени окисления Р 2 О 5 -2 +10 -10 5. Найдите величину положительной степени окисления, разделив ее на индекс у этого элемента (+10) ꞉ 2 = +5 6. Поставьте значение степени окисления Р 2 +5 О 5 -2 Определить степени окисления в соединении K 2 Cr 2 O 7 У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)7=(-14), у калия (+1)2=(+2). Число положительных степеней окисления равно числу отрицательных. Следовательно (-14)+(+2)=(-12).
Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит на один атом приходится (+12):2=(+6), записываем степени окисления над элементами К + 2 Cr +6 2 O -2 7 Алгоритм составление химических формул по степени окисления 1. Записать химические знаки элементов Аl S 2. Определить степень окисления Аl +3 S -2 3. Найти наименьшее общее кратное и определить индексы Аl +3 S -2 НКО =6 4.Формула Аl 2 +3 S 3 -2 Алгоритм составления уравнений реакций Последовательность действий Пример 1.
В левой части уравнения приведем формулы веществ, вступающих в реакцию (реагентов) Р+ O 2→ 2. В правой части после стрелки пишем формулы веществ, образующихся в результате реакции(продуктов) Р + O 2→Р 2O 5 3 С помощью коэффициентов начинаем уравнивать число тех атомов,которых в реакцию вступает больше (через НОК) нок 10 Р+ 5O 2→2Р 2O 5 4.
Программа Для Составления Химических Уравнений
С помощью коэффициентов уравниваем число других атомов 4Р+ 5O 2→2Р 2O 3 Составление уравнений окислительно-восстановительных реакций В методе электронного баланса сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции.
Программа Для Составления Химических Реакций Онлайн
Расставить коэффициенты в реакции, схема которой: HCl + MnO 2 Cl 2 + MnCl 2 + H 2O Алгоритм расстановки коэффициентов 1.Указываем степени окисления химических элементов. Подчёркнуты химические элементы, в которых изменились степени окисления. 2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов. За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl 2 тоже -1.
Программа Для Составления Химических Реакций
Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно, и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H 2O коэффициент - 2. В результате получится химическое уравнение: Рассмотрим более сложное уравнение: H 2S + KMnO 4 + H 2SO 4 S + MnSO 4 + K 2SO 4 + H 2O Расставляем степени окисления химических элементов: Электронные уравнения примут следующий вид Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции Алгоритм составления окислительно- восстановительных реакций Последовательность действий Пример Составить схему реакции. CuCl 2 + Al AlCl 3 + Cu Определить элементы, атомы которых изменили степень окисления в результате реакции. +2-1 0 +3-1 0 CuCl 2 + Al AlC l3 + Cu Найти окислитель и восстановитель. +2 0 Cu + 2ē = Cu восстановление окислитель 0 +3 Al - 3ē = Al окисление Восстановитель Составить электронные уравнения для процессов окисления и восстановления +2 0 Cu + 2ē = Cu 3 восстановление окислитель 0 +3 Al - 3ē = Al 2 окисление Восстановитель Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, а затем – перед формулами окислителя и восстановителя 3 CuCl 2 + 2Al 2AlCl 3 + 3Cu Составление ионных уравнений реакций Последовательность действий Пример 1.
Записать молекулярное уравнение реакции, подобрать коэффициенты АlСl 3 + 3КОН→Аl(ОН) 3↓+ 3КСl 2. С помощью таблицы растворимости определить растворимость каждого вещества АlСl 3 – р; КОН – р; Аl(ОН) 3↓- н; КСl - р 3.
Составить полное ионное уравнение реакции, записав электролиты в виде ионов, неэлектролиты – в молекулярном виде Аl 3+ +3Сl - + 3К 3ОН -→Аl(ОН) 3↓+ 3К 3Сl - 4. Составить сокращенное ионное уравнение реакции, сократив одинаковые ионы в левой и правой частях уравнения Аl 3+ +3ОН -→Аl(ОН) 3↓.